Cerchiamo sempre di essere precisi: non esiste una "forma sinistra" di una sostanza. Non significa nulla. Si tratta del fatto che una soluzione di questa sostanza, attraversata da una luce polarizzata, vede il suo piano di polarizzazione deviato verso sinistra, se è "levogiro".
[In semplice: la luce essendo onde, queste vibrano, per una luce naturale, anarchicamente, in tutte le direzioni; la luce polarizzata è luce in cui tutte le onde vibrano sullo stesso piano - piani molto esattamente paralleli; un po 'come se fossero passati attraverso un pettine. Incrociando la soluzione, questo piano viene deviato o a sinistra, nella forma "levogira" di una sostanza, oa destra nella forma "destrogira". Chiamare un enantiomero D o L è, d'altra parte, convenzionale - dipende dalla posizione dei radicali sul primo carbonio].
Chiralità dei fertilizzanti azotati sintetici ... nocivi?
-
izentrop
- esperto Econologue

- post: 13715
- iscrizione: 17/03/14, 23:42
- Località: Picardie
- x 1524
- Contatti:
Ri: Chiralità dei fertilizzanti azotati sintetici ... dannosi?
Le molecole hanno una forma che può essere rappresentata in prospettiva da una rappresentazione 3D, in disegno dalla rappresentazione di Cram http://www.faidherbe.org/site/cours/dup ... p.htm#cram.
Quando è cristallizzato, è decisamente visibile:
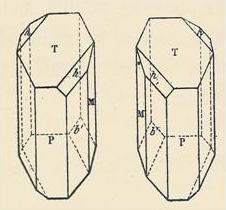
"Cristalli enantiomerici di sodio ammonio tartrato separati da Pasteur."
Quando è cristallizzato, è decisamente visibile:

"Cristalli enantiomerici di sodio ammonio tartrato separati da Pasteur."
0 x
Ri: Chiralità dei fertilizzanti azotati sintetici ... dannosi?
Come chimico, posso confermare che questa storia di chiralità è una cazzata. I nitrati e l'ammonio non sono molecole chirali perché ci sono elementi di simmetria in queste molecole. Per essere chirale è necessario essere asimmetrici (legame con 4 gruppi diversi per un carbonio tetraedrico tipicamente chiamato sp3).
Mi viene in mente quei pub in cui usiamo le parole imparate per impressionare: bucato con ossigeno attivo, rigenerazione XY ...
Sì, ci sono "grandi scienziati" che spesso escono dai binari andando al di fuori del loro campo di competenza. Montagnier (premio Nobel) è oggi uno degli ardenti difensori della memoria dell'acqua (esegue esperimenti di fisica e bio per "provarla"), Paulin (anche nobel) era convinto di poter curare tutti i tumori da imbottito di vitamina C, il chirurgo oncologo del professor Joyeux (cancellato da tempo) che spiega a tutti i costi i danni della vaccinazione. Questo fenomeno è stato soprannominato la sindrome del premio Nobel:
http://www.sceptiques.qc.ca/dictionnair ... sease.html
Mi viene in mente quei pub in cui usiamo le parole imparate per impressionare: bucato con ossigeno attivo, rigenerazione XY ...
Sì, ci sono "grandi scienziati" che spesso escono dai binari andando al di fuori del loro campo di competenza. Montagnier (premio Nobel) è oggi uno degli ardenti difensori della memoria dell'acqua (esegue esperimenti di fisica e bio per "provarla"), Paulin (anche nobel) era convinto di poter curare tutti i tumori da imbottito di vitamina C, il chirurgo oncologo del professor Joyeux (cancellato da tempo) che spiega a tutti i costi i danni della vaccinazione. Questo fenomeno è stato soprannominato la sindrome del premio Nobel:
http://www.sceptiques.qc.ca/dictionnair ... sease.html
0 x
-
izentrop
- esperto Econologue

- post: 13715
- iscrizione: 17/03/14, 23:42
- Località: Picardie
- x 1524
- Contatti:
Ri: Chiralità dei fertilizzanti azotati sintetici ... dannosi?
Buongiorno,
E cosa significa questo per un non chimico? Stiamo parlando di chiralità, ma instabile?
E cosa significa questo per un non chimico? Stiamo parlando di chiralità, ma instabile?
Le ammine di tipo RR′R "N e RR′NH sono chirali, ma non è possibile ottenerle sotto forma di un unico enantiomero puro a causa della rapidità di inversione dell'azoto tranne in casi eccezionale come per gli invertomeri; la situazione è però molto diversa per i sali di ammonio, RR′R ″ HN + e RR′R ″ R ‴ N +, o per gli ossidi di ammina, RR′HNO e RR′R ″ NO, che sono otticamente stabili Allo stesso modo, le corrispondenti fosfine chirali (RR′R ″ P e RR′PH), sali di solfonio (RR′R ″ S +) e solfossidi (RR′SO) sono otticamente stabili. https://fr.wikipedia.org/wiki/Inversion_de_l%27azote
0 x
Ri: Chiralità dei fertilizzanti azotati sintetici ... dannosi?
izentrop ha scritto:Buongiorno,
E cosa significa questo per un non chimico? Stiamo parlando di chiralità, ma instabile?Le ammine di tipo RR′R "N e RR′NH sono chirali, ma non è possibile ottenerle sotto forma di un unico enantiomero puro a causa della rapidità di inversione dell'azoto tranne in casi eccezionale come per gli invertomeri; la situazione è però molto diversa per i sali di ammonio, RR′R ″ HN + e RR′R ″ R ‴ N +, o per gli ossidi di ammina, RR′HNO e RR′R ″ NO, che sono otticamente stabili Allo stesso modo, le corrispondenti fosfine chirali (RR′R ″ P e RR′PH), sali di solfonio (RR′R ″ S +) e solfossidi (RR′SO) sono otticamente stabili. https://fr.wikipedia.org/wiki/Inversion_de_l%27azote
Le ammine menzionate in questo testo sono asimmetriche (in effetti parla di tutti i diversi sostituenti sull'atomo di azoto), in questo caso possiamo parlare di chiralità. Il lato instabile deriva dal fatto che la molecola oscilla molto rapidamente tra la sua forma sinistra e destra a temperatura ambiente e quindi il tempo per misurare la deviazione del piano di polarizzazione di una luce polarizzata la molecola ha fatto un elevato numero di inversioni e noi osservare la deviazione media che è zero.
Per un ammonio, questo problema di inversione non esiste più, ma ancora per essere chirale, un ammonio deve avere sostituenti diversi sull'azoto (ad esempio R, R ', R' ', H). l'ammonitrato che è la fonte più diffusa di azoto convenzionale è il nitrato NO3- e ammonio NH4 +, quindi un ammonio simmetrico e achirale ...
0 x
Di nuovo a "Agricoltura: problemi e l'inquinamento, nuove tecniche e soluzioni"
Chi è in linea?
Utenti che lo stanno visitando forum : Nessun utente registrato e ospite 310


